Per contraccezione, definita anche come controllo delle nascite o controllo della fertilità, si intendono i metodi o i dispositivi utilizzati per prevenire la gravidanza. Esistono più tipi di farmaci e metodi contraccettivi. Esaminiamo i principali.
Contraccettivi ormonali
– Pillola
– Cerotto
– Anello vaginale
– Spirale medicata
– Impianti sottocutanei
Contraccettivi di barriera
– Diaframma
– Profilattico
Contraccettivi di interferenza
– Spirale
Metodi naturali
Coito interrotto, Ogino-Knaus, Temperatura basale, Billings, Sintotermico
CONTRACCETTIVI ORMONALI
La “pillola”
Quando si parla di pillola, si intende comunemente un’associazione farmacologica di due ormoni: l’Etinilestradiolo e un progestinico (nelle pillole in commercio sono 7 i possibili progestinici: Gestodene, Desogestrel, Levonorgestrel, Ciproterone acetato, Drospirenone, Noretisterone, Norgestrel). La differenza tra le varie pillole in commercio sta nel dosaggio dell’Etinilestradiolo (da 50 a 15 mcg), nel tipo di progestinico usato (ogni progestinico ha effetti leggermente diversi) e nel tipo di combinazione tra i due ormoni: esistono infatti pillole in cui il dosaggio dei due ormoni è fisso per tutti i giorni dell’assunzione (pillole “monofasiche”) ed altre in cui il dosaggio di uno o entrambi varia per due o tre volte a seconda dei giorni del ciclo (pillole bifasiche e trifasiche).
Si parla di pillole a basso dosaggio per quantitativi di etinilestradiolo uguali o inferiori a 30 mcg). Sono comunque di uso comune anche altre formulazioni a dosaggi lievemente maggiori che, in casi selezionati possono garantire ottimi risultati.
I vari progestinici, sopra citati, hanno effetti lievemente diversi
– nell’azione sull’endometrio (il tessuto che tappezza internamente l’utero) ovvero nella capacità di renderlo atrofico (una eccessiva atrofia può essere negativa specialmente in una donna giovane).
– nella azione androgenica che consta di effetti positivi (ad esempio aumento della libido) ma anche di effetti negativi (quali acne, irsutismo, aumento di peso, alterazioni del profilo lipidico specie del colesterolo).
L’effetto della pillola deve essere valutato caso per caso: una pillola perfetta per una paziente può essere scarsamente tollerata da un’altra.
L’azione anticoncezionale si basa su tre effetti: l’inibizione dell’ovulazione , l’alterazione del muco cervicale (il muco diventa denso rendendo difficoltoso il passaggio degli spermatozoi) e l’alterazione (la sua alterazione rende poco probabile l’impianto di un eventuale gravidanza).
Dal punto di vista generale sono infondati i “terrori” sugli effetti negativi della pillola. La pillola ha effetti benefici sulla mammella nel caso di mastopatia fibrocistica, riduce l’incidenza dei tumori ovarici (specialmente le pillole con almeno 30 mcg di Etinilestradiolo) non aumenta l’incidenza di altri tumori. L’unico aumento di rischio sarebbe per il tumore alla mammella quando l’uso della pillola viene iniziato in giovane età (inferiore ai 17anni) e continuato per almeno 8-10 anni consecutivi prima della prima gravidanza.
Il rischio di trombosi viene lievemente aumentato dall’uso della pillola anche se con le moderne pillole a basso dosaggio è un rischio contenuto; il rischio aumenta invece notevolmente associando all’uso della pillola il fumo di sigaretta; le utilizzatrici della “pillola” dovrebbero sospendere il fumo o ridurlo almeno il più possibile; importante inoltre un attento screening della coagulazione, prima di iniziare l’utilizzo del farmaco, al fine di identificare lievi anomalie (genetiche o costituzionali) che potrebbero aumentare il rischio. Sarà inoltre buona norma effettuare esami ematochimici di controllo annualmente per verificare eventuali effetti collaterali del trattamento.
Le moderne pillole hanno scarsi effetti sul metabolismo lipidico e scarsi effetti sul metabolismo degli zuccheri. Non riducono inoltre la fertilità e alla sospensione della terapia la donna è subito in grado di concepire (salvo che alla base non ci siano patologie ginecologiche pre-esistenti all’uso della pillola o insorte durante il trattamento). Si consiglia comunque, prima di cercare una gravidanza, di aspettare almeno un ciclo regolare, alla sospensione della pillola, per verificare la corretta ripresa dell’attività ovarica. Il primo ciclo potrebbe infatti presentare una scarsa produzione di progesterone. E’ inoltre consigliabile, prima di cercare una gravidanza, iniziare l’assunzione di acido folico, una sostanza chiave nella prevenzione di malformazioni fetali quali la spina bifida e l’anencefalia, dal momento che l’assunzione protratta della pillola potrebbe diminuire i livelli plasmatici di tale sostanza.
In alternativa all’assunzione orale di estro progestinici ma con analogo effetto contraccettivo esiste la possibilità di una somministrazione transdermica (il cerotto) o transvaginale (l’anello).
Il “Cerotto”


Il cerotto contraccettivo (EVRA – ENCIELA) permette il rilascio in circolo, mediante assorbimento cutaneo, di Etinil-estradiolo (EVRA contiene 20 mcg che corrispondono dal punto d vista pratico ai 30 mcg della pillola per os dal momento che c’è un migliore assorbimento; ENCIELA contiene 13 mcg che corrispondono dal punto d vista pratico ai 20 mcg della pillola per os ) e di un progestinico (Norelgestromina per EVRA e Gestodene per ENCIELA). I vantaggi sono legati all’assenza di problemi di assorbimento legati a vomito o diarrea, alla applicazione settimanale del cerotto (e non giornaliera), al basso dosaggio associato ad un controllo ottimale del ciclo.
L’”Anello vaginale”



L’anello vaginale (NUVA-RING) consiste in un piccolo anello morbido da inserire in vagina, per restarvi 21 giorni. L’anello determina rilascio locale di Etinil-estradiolo (15 mcg) e di un progestinico con scarsissima attività androginica: l’Etonogestrel. Nonostante il bassissimo dosaggio ormonale, l’assorbimento per via vaginale permette una completa soppressione dell’ovulazione ed un controllo ottimale del ciclo (raro lo spotting). Dal punto di vista sistemico i bassi livelli ormonali permettono una riduzione degli effetti collaterali quali tensione mammaria, cefalea, ritenzione idrica. Fra i vantaggi dell’anello, il corretto assorbimento degli ormoni anche in presenza di vomito o diarrea, l’applicazione unica, la possibilità costante di verificare la presenza dell’anello in vagina. L’anello inoltre non crea nessun tipo di problema durante i rapporti sessuali.
Oltre alle associazioni estro progestiniche vi è la possibilità di utilizzare dei contraccettivi ormonali contenenti solo progestinici. Tra questi abbiamo la così detta mini-pillola, la spirale medicata e gli impianti sottocutanei: rappresentano una scelta terapeutica per la riduzione del flusso mestruale e della dismenorrea e trovano indicazione in caso di endometriosi e adenomiosi o quando l’associazione estro progestinica è sconsigliata per un aumento del rischio trombotico.
“La pillola di solo progestinico”
La pillola di solo progestinico viene definita anche come mini pillola contraccettiva risultando efficace tanto quanto le più tradizionali pillole contraccettive combinate che, oltre al progestinico, impiegano anche un estrogeno. La sua azione contraccettiva si esplica non solo inibendo l’ovulazione ma agendo anche e prevalentemente a livello del muco cervicale, in modo da impedire la penetrazione degli spermatozoi e la successiva fecondazione. Ha la medesima sicurezza delle pillole contraccettive combinate, ma a differenza di queste ultime è particolarmente indicata per le donne intolleranti all’estrogeno, alle donne in fase di allattamento (per cui è sconsigliato l’impiego di estrogeni), alle donne fumatrici o con età superiore ai 35 anni.
“L’impianto sottocutaneo”


Nexplanon® è un contraccettivo ormonale ad azione protratta che viene inserito per via sottocutanea (ossia appena sotto la pelle) nella zona più interna della parte superiore del braccio. Un singolo impianto può essere lasciato in sito per 3 anni; una sostituzione più precoce dell’impianto può essere necessaria nelle donne sovrappeso. Durante l’utilizzo di questo dispositivo è molto probabile che il profilo mestruale subisca variazioni, come con tutti gli altri metodi con solo progestinico. Tali variazioni possono riguardare la frequenza, l’intensità o la durata del sanguinamento. Nel 20% circa dei casi la donna va incontro all’amenorrea (ossia alla totale assenza di flusso mestruale); in un altro 20% dei casi, invece, si hanno flussi prolungati e/o persistenti che rendono necessaria la rimozione anticipata del dispositivo.
“IUD medicati”


Mirena è un dispositivo intrauterino che ottiene l’effetto contraccettivo rilasciando una dose costante di ormoni ad effetto progestinico direttamente all’interno della cavità uterina. L’effetto contraccettivo quindi deriva sia dal meccanismo di interferenza (come per le altre “spirali”) che da quello ormonale.
Tutti i contraccettivi ormonali non proteggono dalle infezioni sessualmente trasmesse.
METODI DI BARRIERA
Il “profilattico”
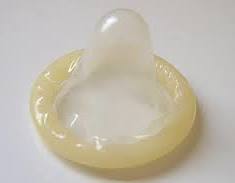

Il profilattico o preservativo o condom è un dispositivo medico utilizzato come contraccettivo. E’ normalmente formato da una sottile guaina di lattice, ma ne vengono realizzati anche in altri materiali per i pazienti allergici. Si adatta perfettamente alla forma ed alla dimensione del pene grazie alla sua notevole elasticità. L’interno è cosparso di sostanze lubrificanti (che servono per evitare irritazioni e dolore all’uomo durante la penetrazione, non essendo il pene a contatto con i lubrificanti naturalmente prodotti dalla vagina prima e durante il rapporto) e/o di spermicidi (sostanze in grado di uccidere gli spermatozoi eiaculati).
E’ il solo contraccettivo che ha anche funzioni di protezione nei confronti di malattie veneree.
Il “diaframma”


Il diaframma è una forma di contraccezione molto utilizzata negli anni 70 ed 80 ed oggi fuori uso nei paesi industrializzati; lo descriviamo perché esistono ancora delle società che lo contemplano nelle loro scelte contraccettive pur con tutti i limiti di inaffidabilità e difficoltà logistiche che lo contraddistinguono. E’ formato da una piccola semisfera di gomma soffice con un anello flessibile in gomma a forma di ‘O’ nel bordo che l’utilizzatrice riempie con uno spermicida (sostanza che uccide o inibisce gli spermatozoi) prima d’inserirlo in vagina per creare una barriera davanti alla cervice uterina , e dunque per evitare che gli spermatozoi vi penetrino. Deve essere inserito qualche tempo prima (sufficiente a controllare il buon inserimento) del rapporto sessuale e deve rimanere inserito nella vagina da 6 a 8 ore (dipendendo dalla potenza del gel oppure della schiuma contraccettiva utilizzata), in modo che lo spermicida abbia tempo per agire. Dopo questo intervallo, il diaframma può essere delicatamente rimosso, lavato in acqua tiepida saponosa, e rimesso nel suo astuccio (simile ad un portacipria compatto). Ogni diaframma, a seconda del materiale di cui è fatto, può durare da sei mesi fino a due anni; va conservato al riparo dal sole e dal caldo. Ha una efficacia contraccettiva scarsa, con un tasso di fallimento di circa il 20-30% e non protegge dalle malattie sessualmente trasmesse.
CONTRACCETTIVI DI INTERFERENZA



La spirale (o IUD) è un dispositivo in plastica di forma varia, lungo circa cm 4 del peso di pochi grammi, su cui è avvolto un filo di rame. Tutte le spirali hanno un filo terminale che fuoriesce dal collo dell’utero per 3 o 4 cm, in modo che la paziente stessa, specialmente dopo ogni mestruazione, possa agevolmente controllare la presenza dello IUD, introducendo un dito in vagina e ricercando il filo sul collo dell’utero. L’azione della spirale è collegata a modeste modificazioni locali della mucosa uterina, capaci – insieme a variazioni funzionali delle tube – di disturbare il processo di fecondazione e/o di annidamento dell’uovo. A ciò si aggiunge, nelle spirali al rame, una riduzione della capacita fecondante degli spermatozoi. Uno studio condotto per conto dell’Organizzazione Mondiale della Sanità ha dimostrato che il più frequente meccanismo di azione della spirale è quello di prevenire la fertilizzazione dell’uovo, e perciò funziona più come contraccettivo che come miniabortivo.
(-> sempre in utiliy- ginecologia è a vostra disposizione una sezione specifica per lo IUD con modalità di inserimento, controindicazioni etc, che funge anche da consenso informato qualora la paziente decida per l’utilizzo di questo metodo)
I “METODI NATURALI”
I metodi naturali si prestano al caso di coppie stabili per le quali l’eventuale gravidanza non rappresenterebbe un problema. Hanno infatti una efficacia contraccettiva ridotta e non proteggono, ovviamente, dalle malattie sessualmente trasmesse.
Metodo del “coito interrotto”.
Consiste nell’interruzione del rapporto, prima dell’eiaculazione, in modo da evitare il contatto tra il liquido seminale e i genitali femminili. E’ un metodo fallimentare in quanto anche prima dell’eiaculazione possono essere emessi, in maniera inavvertita, spermatozoi. La Percentuale di fallimento è superiore al 30%.
Metodo Ogino-Knaus.
Si basa sul calcolo delle date dei giorni fertili in base alla durata dei cicli mestruali precedenti. La fase fertile viene identificata individuando il più breve ed il più lungo ciclo mestruale dell’anno precedente, sottraendo 19 giorni alla lunghezza del ciclo più breve e 11 a quella del ciclo più lungo, per stabilire rispettivamente il primo e l’ultimo giorno della fase fertile. I problemi legati all’adozione di questo metodo derivano dal fatto che non sempre le donne hanno cicli regolari per cui, senza lunghi periodi di astinenza, non è possibile evitare la gravidanza.
Metodo della temperatura basale.
Consiste nella misurazione quotidiana della temperatura corporea; la temperatura in prossimità dell’ovulazione subisce un incremento che si mantiene per diversi giorni. Il metodo prevede la possibilità di rapporti sicuri dal terzo giorno successivo al massimo aumento della temperatura fino alla comparsa del successivo ciclo mestruale. Esistono attualmente mini-computer (“contraccettivi tecnologici”) per ottimizzare l’analisi della temperatura basale riducendo i rischi di “erronea” interpretazione dei dati e determinando quindi maggiore sicurezza contraccettiva. Tali dispositivi permettono la rilevazione accurata della temperatura basale in modo sublinguale in pochi secondi, l’analisi statistica del periodo fertile, ecc. Anche per questo metodo la % di fallimento è molto alto (sia per la “versione” storica che per quella”tecnologica”.
Metodo Billings.
Valutazione della quantità e della qualità delle secrezioni vaginali da parte della donna stessa: in prossimità dell’ ovulazione le perdite vaginali diventano abbondanti e con aspetto a “chiara d’uovo” e la donna avverte una caratteristica sensazione di “umidità”. Successivamente le secrezioni ritornano ad essere scarse e meno vischiose. Il periodo sicuro sarebbe subito dopo le mestruazioni quando la donna avverte una sensazione di secchezza dei genitali. Appena inizia una sensazione di maggiore “umidità” è il segnale che avere rapporti non è più sicuro. E’ di nuovo periodo sicuro quando termina il massimo picco di “umidità” (deve essere passato da almeno 3 giorni) e ritorna una sensazione di secchezza. Inutile dire che la percezione del secco ed umido è estremamente soggettiva e che le secrezioni possono essere aumentate e/o ridotte per stati infiammatori o infettivi interferendo quindi sul giudizio già di per sé molto empirico…del periodo fertile.
Metodo sintotermico.
Misurazione della temperatura basale e contemporanea valutazione delle secrezioni vaginali.